2025.06.23
제품 개발
- "식품의약품안전처로부터의 IDE 변경 승인"
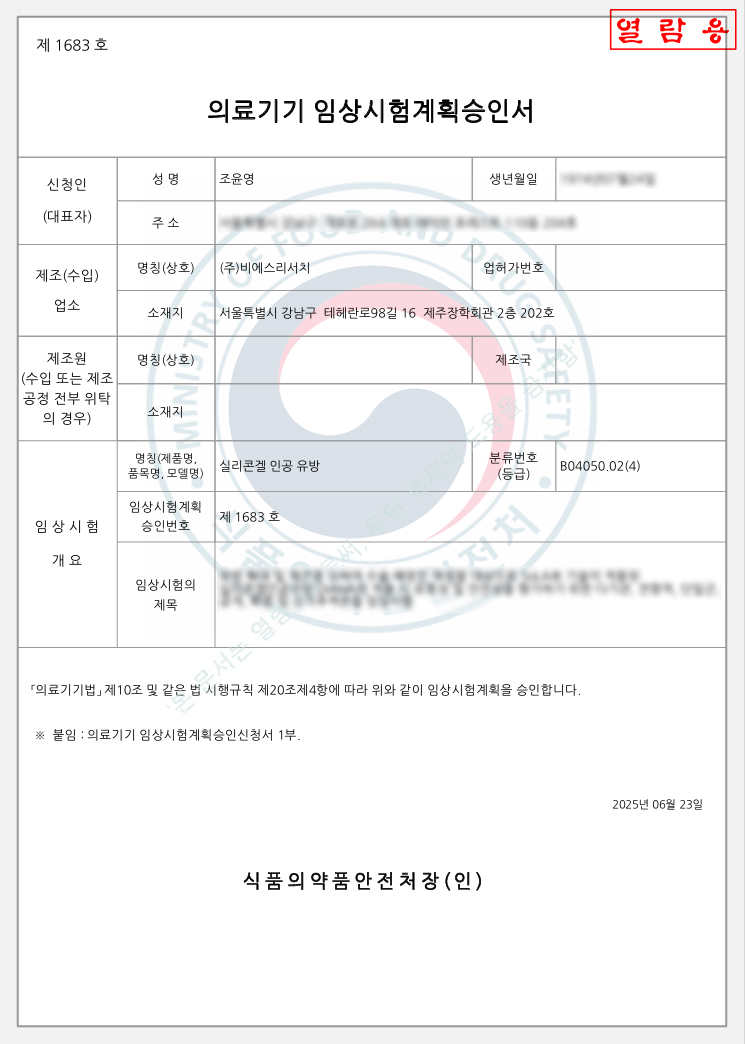
식품의약품안전처, 비에스리서치 인공유방 보형물에 대한 임상시험계획(IDE) 승인
환자 안전과 혁신을 동시에 추구하는 차세대 보형물 개발의 중대한 이정표
의료기기 개발 및 표면개질 플랫폼 전문기업 주식회사 비에스리서치(BS Research Co., Ltd.)는 자사가 개발한 차세대 실리콘겔 인공유방 보형물이 2025년 6월 23일, 식품의약품안전처(MFDS)로부터 임상시험계획(Investigational Device Exemption, IDE) 승인을 획득했다.
이번 IDE 승인을 통해 비에스리서치는 인공유방 보형물의 안전성과 유효성 평가를 위한 최초 인체 대상 임상시험(First-in-Human Clinical Trial)을 국내에서 본격적으로 착수할 수 있게 되었다. 이는 환자 안전, 수술 안정성, 심미적 결과를 모두 충족하는 최첨단 생체적합성 보형물 기술 상용화를 위한 중대한 전환점이 될 것으로 기대된다.
비에스리서치 조윤영 대표는 “이번 MFDS 승인은 수년간의 연구개발이 결실을 맺은 의미있는 성과이며, 환자들에게 더 안전하고 과학적 근거에 기반한 의료기기를 제공하는 데 한걸음 더 가까워졌음을 의미한다”고 전했다.
이번 임상시험은 2025년 3분기 착수 예정이며, 국내 유수의 의료기관과 유방 재건 및 확대 성형 분야 전문 의료진과의 협업을 통해 진행될 예정이다.